Ⅰ.考试内容及要求
总要求:
1.初步掌握元素周期律,化学热力学。近代热力学。近代物质结构,化学平衡以及基础电化学等基本原理。
2.利用无机化学原理去掌握有关无机化学中元素和化合物的基本知识,并具有对一般无机化学问题进行理论分析和计算的能力。
第1章原子结构和元素周期系
(一)考核知识点:
1.分子,原子,元素,摩尔(国际单位制和我国法定计量单位的基本内容),相对原子质量和相对分子质量等基本概念;
2.理想气体定律;
3.核外电子运动的特点、量子化、描述核外电子运动状态的方法;
4.原子轨道、电子云的涵义及四个量子数的物理意义;
5.原子核外电子排布和元素周期表;
6.元素电离势、电负性和原子结构。
(二)考核要求:
1.掌握理想气体分子状态方程式,气体扩散定律,混合气体的分压定律和分体积定律,熟练有关计算;
2.了解描述核外电子运动状态的方法,明确原子轨道与电子云的涵义,初步了解径向分布与角分布的意义及其与电子云形状的区别和联系;
3.掌握四个量子数的物理意义及其相互联系;
4.了解屏蔽效应、钻穿效应对原子轨道能量的影响,掌握多电子原子的能级高低顺序与核外电子分布的原则,熟练写出常见元素原子的核外电子的分布式;
5.熟练掌握原子电子层结构与元素周期表间的内在联系及其应用;
6.熟练掌握原子半径、电离势、电子亲和势、电负性的涵义及其周期性变化规律。
第2章分子结构
(一)考核知识点:
1.化学键参数和分子的性质;
2.离子键的形成条件、过程与特性;
3.共价键的形成条件、过程与特性;
4.分子轨道理论简介;
5.分子间作用力和氢键。
(二)考核要求:
1.掌握共价键的形成条件,过程与特性,明确σ键与π键的区别;了解键的离解能、键长、键能、键角及键的极性的涵义;
2.了解原子轨道杂化的涵义,掌握杂化轨道的几种主要类型及其对分子几何构型的影响;
3.掌握价层电子对互斥理论的基本内容及其用;
4.明确分子的磁性及极性与分子结构的关系;
5.掌握分子间作用力形成及分子间力对物质性质的影响;
6.掌握形成氢键的条件及氢键对物质性质的影响。
第3章晶体结构
(一)考核知识点:
1.离子半径;
2.晶体的特征,离子晶体、原子晶体、分子晶体、金属晶体、混合型晶体质点间作用力。
3.离子极化
(二)考核要求:
1.明确各种类型晶体质点间作用力的区别及其对物质性质的影响;
2.掌握离子极化、极化力与变形性的概念,了解其影响因素与初步应用。
第4章配位化合物
(一)考核知识点:
1.配合物的形成及性质变化;
2.配合物的特征、组成、定义、分类与命名;
3.配合物价键理论的要点及局限性;
4.配合物顺反异构现象;
(二)考核要求:
1.掌握配合物的涵义,组成。
2.掌握配合物价键理论的基本要点及对配合物磁性,配位数,空间构型和稳定性的解释。
3.了解晶体场理论的基本要点和应用。
第5章化学热力学初步
(一)考核知识点:
1.热力学概论;
2.热力学第一定律表述及其数学表达式,热化学及其反应热效应的计算;
3.化学反应的方向判据;
4.吉布斯-亥姆霍兹公式的初步应用;
5.温度对化学平衡的影响。
(二)考核要求:
1.理解焓和焓变的概念。吉布斯自由能和熵及它们的变化的初步概念。初步学会用吉布斯自由能变化去判断化学反应的方向;
2.会运用盖斯定律进行计算。会从函数表中查(△fHo、△fGo和So),并会用于计算在标准状态下反应的焓变化、吉布斯自由能变化和熵变化;
3.理解化学反应等温式的含义,会用其求算△rGmo和Ko;
4.根据吉布斯-亥姆霍兹公式理解△H、△G、△S的关系,会用于分析温度对化学反应自发性的影响。
第6章化学平衡
(一)考核知识点
1.化学平衡的条件、概念、平衡常数;
2.外界条件对化学平衡移动的影响.
(二)考核要求:
1.掌握化学平衡的概念,平衡常数的物理意义,有关化学平衡的计算与应用;
2.熟悉有关平衡移动原理。
第7章化学反应速率
(一)考核知识点
1.化学反应速率;
2.浓度、温度、催化剂对化学反应速率的影响。
(二)考核要求:
1.了解化学反应速率、基元反应、复杂反应、反应级数、反应分子数的概念;
2.掌握浓度、温度及催化剂对反应速率的影响;
3.初步了解活化能的概念及其与反应速率的关系。
第8章溶液
(一)考核知识点
1.溶液的浓度和溶解度;
2.非电解质稀溶液通性(溶液的蒸气压下降,溶液的凝固点下降,溶液的沸点上升,溶液的渗透压);
3.稀溶液的依数性;
4.电解质溶液。
(二)考核要求:
1.掌握溶液浓度的各种表示方法;
2.初步了解强电解质溶液理论;了解离子氛、离子强度、活度、活度系数等概念;
3.了解溶解度原理及分配定律;
4.理解非电解质稀溶液的依数性及其应用;
5.熟悉溶胶的结构、性质、稳定性及聚沉作用;
6.了解高分子溶液的定义及性质。
第9章酸碱平衡
(一)考核知识点
1.酸碱理论;
2.水的离子积和pH;
3.酸碱溶液中的电离平衡;
4.水溶液化学平衡的计算(一元弱酸,一元弱碱,多元酸,多元碱,酸碱两性物质,同离子效应);
5.缓冲溶液。
(二)考核要求:
1.了解酸碱理论的发展概况,掌握酸碱质子理论的基本要点;
2.掌握溶液酸度的概念和pH的意义,熟悉pH与氢离子浓度的互换,了解拉平效应和区分效应;*
3.掌握酸碱的电离常数,掌握同离子效应及有关离子浓度的计算,了解盐效应;*
4.了解缓冲溶液的组成;缓冲作用原理;缓冲溶液的性质;掌握缓冲溶液pH值的计算;
5.了解酸碱理论发展的概况。
第10章沉淀平衡
(一)考核知识点
1.浓度积常数,溶液度原理,溶度积与溶解度,同离子效应;
2.沉淀与溶解:金属氢氧化物沉淀的生成-溶解,难溶硫化物沉淀与溶解,沉淀转化。
(二)考核要求:
1.掌握Ksp的意义及溶度积规则;
2.了解沉淀的生成、溶解和转化。
3.熟悉有关Ksp的计算
第11章氧化还原反应
(一)考核知识点:
1.氧化还原的基本概念,氧化还原反应和电极电势;
2.标准电极电势、影响电极电势的因素;
3.化学电源与电解简介。
(二)考核要求:
1.掌握电极电势的概念及标准电极电势的应用;
2.掌握应用能斯特方程和有关的计算。
第12章配位平衡
(一)考核知识点:
1.配合物的稳定常数;
2.影响配合物在溶液中的稳定性的因素。
(二)考核要求:
1.理解配位离解平衡的意义及有关计算;
2.了解影响配位化合物稳定性的因素。
第13章氢和稀有气体
(一)考核知识点:
1.氢的存在和物理性质;氢的化学性质和氢化物;
2.稀有气体。
(二)考核要求:
1.掌握氢的物理和化学性质;
2.一般了解稀有气体的单质的性质、用途和从空气中分离它们的方法;
3.了解稀有气体化合物的性质和结构。
第14章卤素
(一)考核知识点:
1.卤素元素通性;
2.卤素单质及其主要化合物卤化氢和氢卤酸、卤化物、卤素互化物、多卤化物、卤素的含氧化合物的重要性质;
3.拟卤素的性质、结构和用途。
(二)考核要求:
1.掌握卤素单质及其主要化合物的重要性质、用途与制备方法;
2.掌握应用元素周期律与物质结构初步理论分析归纳卤素单质及其主要化合物的共性,变化规律和氟的特殊性;
3.熟练应用元素电势图分析卤素及其主要化合物的氧化还原性能。
第15章氧族元素
(一)考核知识点:
1.氧族元素的通性;
2.氧、臭氧、氧化物及过氧化氢的制备、结构、性质和用途;
3.硫,硫的氢化物、硫的氧化物、含氧酸及其盐的制备、结构、性质和用途;。
4.硒和碲。
(二)考核要求:
1.掌握氧、臭氧、氧化物及过氧化氢的制备、结构、性质和用途;
2.掌握硫,硫的氢化物、硫的氧化物、含氧酸及其盐的制备、结构、性质和用途;
3.初步了解硒、碲化合物的一般性质。
第16章氮磷砷
(一)考核知识点:
1.氮族元素的通性;
2.氮和氮的氢化物、氧化物、含氧酸及其盐的制备、结构、性质和用途;
3.磷及其重要化合物(氢化物、卤化物、氧化物、磷酸等)的结构、性质和用途;
4.砷。
(二)考核要求:
1.掌握氮和氮的氢化物、氧化物、含氧酸及其盐的制备、结构、性质和用途;
2.掌握磷及其重要化合物(氢化物、卤化物、氧化物、磷酸等)的结构、性质和用途;
3.砷单质及化合物的性质递变规律。
第17章碳硅硼
(一)考核知识点:
1.碳、硅、硼三种元素单质、化合物的性质以及相应的结构特征;
2.碳硅硼的氢化物、卤化物以及碳化物、硅化物、硼化物的性质和结构特征;
3.含氧酸的氧化还原性和酸性强度的影响因素和规律。
(二)考核要求:
1.掌握碳、硅、硼三种元素及其单质的共性、特性以及相应的结构特征;
2.掌握碳硅硼的含氧化合物(氧化物、含氧酸及盐)的基本性质、结构特征,了解天然硅酸盐组成的复杂性和基本结构类型;
3.掌握碳硅硼的氢化物、卤化物以及碳化物、硅化物、硼化物的性质和结构特征。
第18章非金属元素小结
(一)考核知识点:
1.分子型氢化物的热稳定性、还原性、水溶液酸碱笥和无氧酸的强度;
2.最高氧化态氢氧化物的酸碱性,含氧酸的强度;
3.非金属含氧酸的溶解性、水解性、热稳定性及其盐的氧化还原性。
(二)考核要求:
1.理解非金属元素的单质、分子型氢化物、无氧酸、含氧酸和含氧酸盐的重要性质和递变规律。
第19章s区金属(碱金属碱土金属)
(一)考核知识点:
1.碱金属与碱土金属通性;
2.碱金属与碱土金属单质及其化合物;
3.对角线规则。
(二)考核要求:
1.掌握IA、IIA的单质,不同类型氧化物,氢氧化物及主要盐类的性质用途及制备;
2.掌握应用元素周期律,物质结构及电势图等基础理论。分析比较IA、IIA金属单质与化合物的相似性及差异;
3.初步掌握对角线规则及其应用。
第20章p区金属
(一)考核知识点:
1.Al、Sn、Pb、Sb、Bi的单质及其化合物的性质;
2.P区金属6S2电子的稳定性。
(二)考核要求:
1.掌握Al、Sn、Pb、Sb、Bi的单质及其化合物的性质,了解其用途;
2.了解锗分族单质及化合物的性质变化规律;
第21章ds区金属
(一)考核知识点:
1.铜族元素的通性;
2.铜族元素在自然界的存在及冶炼;
3.铜元素的重要化合物性质及Cu(I)与Cu(II)的相互转化。金、银的重要化合物,配合物;
4.锌族元素通性;
5.锌族单质及其化合物的性质和用途,Hg(I)和Hg(II)之间的相互转化。
(二)考核要求:
1.掌握铜、锌、银、汞的冶炼,性质和用途;
2.掌握铜、银、锌、汞氧化物,氢氧化物及主要盐类的性质和用途;。
3.掌握Cu(I)与Cu(II)、Hg(I)和Hg(II)之间相互转化关系。
第22章过渡元素(一)
(一)考核知识点:
1.过渡元素概述;
2.过渡元素钛、钒、铬、钼、钨、锰的单质和化合物的性质,用途;
3.晶体场理论的基本要点及其应用;
4.铁系元素通性;
5.铁系元素单质及其重要化合物的性质、结构和用途;
6.铂系元素。
(二)考核要求:
1.掌握过渡元素的价电子层构型的特点及其过渡元素通性的关系;
2.掌握过渡元素钛、钒、铬、锰的单质和化合物的性质,用途;
3.掌握铁、钴、镍单质及其重要化合物的性质结构和用途;
4.一般了解铂系元素的性质,化合物和用途。
第23章镧系元素和锕系元素
(一)考核知识点:
1.镧系元素、锕系元素的通性;
2.、镧系和锕系元素的化合物的性质及用途。
(二)考核要求:
1.掌握镧系和锕系元素原子的电子层结构性质的关系;
2.掌握镧系收缩的定义、实质及影响。
Ⅱ考试形式及试卷结构
5.考试形式为闭卷、笔试,试卷满分为100分,考试时间为120分钟。
6.试卷内容比例:第1章~第4章约占40%,第5章~第12章约占30%,第13章~第23章约占30%。
7.试卷题型比例:单项选择题20~30%;填表及填空题:20~40%;计算题10~30%,综合题20~30%。
8.试题难易比例:易、中、难分别约为30%、50%、20%。
Ⅲ参考书目
《无机化学》(上、下册)北京师范大学、华中师范大学、南京师范大学合编高等教育出版社第四版
Ⅳ题型示例
一、选择题
1.对于原子中的电子,下面哪些量子数组是容许的?()
A.n=3,l=1,m=2
B.n=2,l=2,m=-1
C.n=6,l=0,m=0
D.n=4,l=-2,m=1
2.含有下列离子的溶液,与Na2S溶液反应不生成黑色沉淀的一组是()
(A)Fe2+,Bi3+
(B)Fe3+,Cu2+
(C)Cd2+,Zn2+
(D)Mn2+,Pb2+
二、填表题
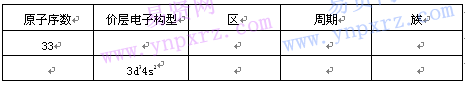
三、填空题
1.将Ni+2Ag+=2Ag+Ni2+氧化还原反应设计为一个原电池。则电池的负极反应为,正极反应为,原电池符号为_。则原电池的标准电动势为。已知(Ni2+/Ni)=-0.25V,(Ag+/Ag)=0.80V。
2.PCl5(g)分解反应,在473K达平衡时有48.5%分解,在573K达平衡时有97%分解,此反应的____________0。(填>、<或=)
四、写出下列反应方程式
1.PCl5+H2O
2.MnO4-+NO2-+H+
五、推断题
某金属盐溶液,(1)加入Na2CO3溶液后,生成灰绿色沉淀;(2)再加入适量Na2O2,并加热,得黄色溶液;(3)冷却,并酸化黄色溶液,得橙色溶液;(4)再加入H2O2溶液呈蓝色;(5)这蓝色化合物在水中不稳定,而在乙醚中较稳定。问这金属离子是什么?写出各步反应方程式。
六、计算题
1.在10mLMnCl2溶液加入10mL含NH4Cl的氨水溶液,计算含多少克NH4Cl才不至生成Mn(OH)2沉淀?(;Kb(NH3)=1.77×10-5)